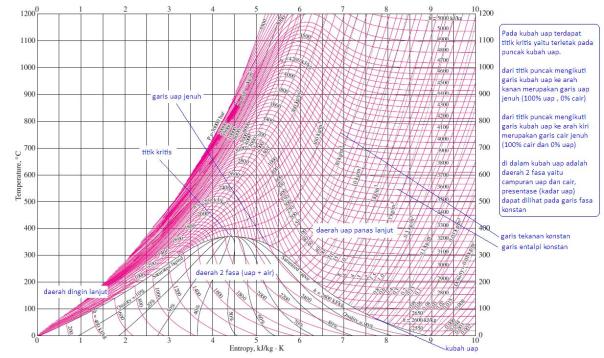
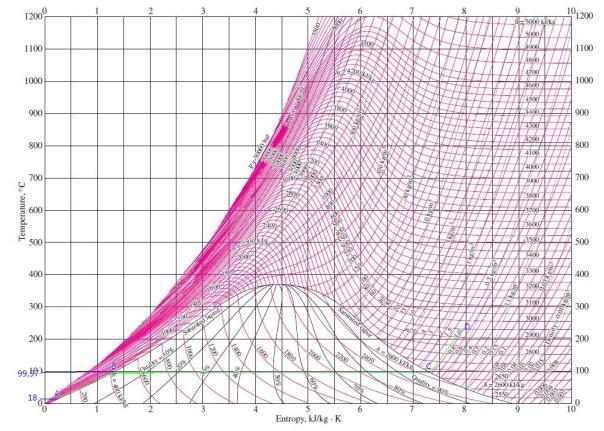
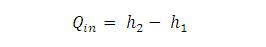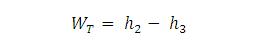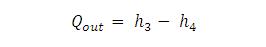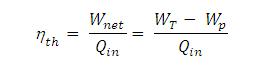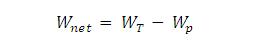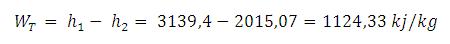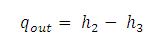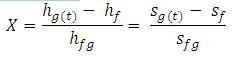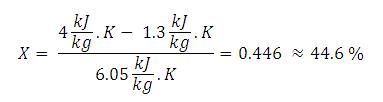Air panas lebih cepat membeku ketimbang air dingin.

Air panas lebih cepat membeku ketimbang air dalam suhu kamar.
Sebagian besar orang sudah mengetahui bahwa air panas lebih cepat membeku ketimbang air dingin. Namun bagaimana fenomena ini terjadi telah menjadi misteri selama bertahun-tahun.
Dikenal sebagai efek Mpemba, air berperilaku tak seperti kebanyakan cairan lain dengan membeku lebih cepat dan padat dari keadaan panas dibandingkan suhu kamar. Para ilmuwan telah mengajukan puluhan teori mengapa hal ini mungkin terjadi. Tetapi, tidak ada yang mampu memberikan penjelasan memuaskan.
Kini, sekelompok fisikawan dari Nanyang Technological University, Singapura, percaya bahwa mereka mungkin telah memecahkan misteri tersebut. Para ilmuwan ini mengklaim bahwa penjelasan terletak pada interaksi tak biasa antara molekul-molekul air.
Setiap molekul air terikat dengan molekul air lainnya melalui ikatan elektromagnetik yang dikenal sebagai ikatan hidrogen. Seperti diketahui ikatan hidrogen mempengaruhi titik didih suatu senyawa. Pada air, terjadi dua ikatan hidrogen di setiap molekulnya sehingga titik didih air lebih tinggi ketimbang asam florida.
Dr Sun Changqing dan Dr Xi Zhang dari Nanyang Technological University berpendapat bahwa hal ini juga menentukan bagaimana molekul air menyimpan dan melepaskan energi . Mereka menilai, tingkat di mana energi dilepaskan bervariasi dengan keadaan awal air dan air panas dapat melepaskan energi lebih cepat ketika ditaruh dalam lemari pendingin.
"Proses dan laju pelepasan energi dari air bervariasi intrinsik dengan keadaan energi awal dari sumber," ujar Dr Changqing seperti dilansir laman Telegraph.
Pekan lalu, Dr Changqing dan Dr Zhang menerbitkan sebuah makalah di jurnal Scientific Reports yang menunjukkan bagaimana molekul air mengatur diri mereka sendiri ketika membentuk es. Keduanya juga menerbitkan sebuah makalah tentang arXiv Chemical Physicsyang menjelaskan efek Mpemba .
Mereka mengatakan bahwa interaksi antara ikatan hidrogen dan ikatan kuat yang memegang atom hidrogen serta oksigen dalam masing-masing molekul bersama -- dikenal sebagai ikatan kovalen-- adalah yang menyebabkan efek Mpemba.
Biasanya ketika cairan dipanaskan, ikatan kovalen antara atom meregang dan menyimpan energi. Namun kedua ilmuwan ini berpandapat bahwa pada air, ikatan hidrogen menghasilkan efek tak biasa yang menyebabkan ikatan kovalen memendek dan menyimpan energi saat dipanaskan.
Hal ini, ujar mereka, mengarah kepada bahwa ikatan melepaskan energi dengan cara yang eksponensial dibanding jumlah awal yang tersimpan ketika didinginkan dalam lemari pendingin. Dengan demikian, air panas akan kehilangan energi lebih cepat ketimbang air dingin.
"Saat didinginkan di lemari pendingin, ikatan H-O melepaskan energi pada tingkat yang eksponensial tergantung pada energi awal yang disimpan dan karena itu efek Mpemba terjadi," kata Dr Changqing.
Dikenal sebagai efek Mpemba, air berperilaku tak seperti kebanyakan cairan lain dengan membeku lebih cepat dan padat dari keadaan panas dibandingkan suhu kamar. Para ilmuwan telah mengajukan puluhan teori mengapa hal ini mungkin terjadi. Tetapi, tidak ada yang mampu memberikan penjelasan memuaskan.
Kini, sekelompok fisikawan dari Nanyang Technological University, Singapura, percaya bahwa mereka mungkin telah memecahkan misteri tersebut. Para ilmuwan ini mengklaim bahwa penjelasan terletak pada interaksi tak biasa antara molekul-molekul air.
Setiap molekul air terikat dengan molekul air lainnya melalui ikatan elektromagnetik yang dikenal sebagai ikatan hidrogen. Seperti diketahui ikatan hidrogen mempengaruhi titik didih suatu senyawa. Pada air, terjadi dua ikatan hidrogen di setiap molekulnya sehingga titik didih air lebih tinggi ketimbang asam florida.
Dr Sun Changqing dan Dr Xi Zhang dari Nanyang Technological University berpendapat bahwa hal ini juga menentukan bagaimana molekul air menyimpan dan melepaskan energi . Mereka menilai, tingkat di mana energi dilepaskan bervariasi dengan keadaan awal air dan air panas dapat melepaskan energi lebih cepat ketika ditaruh dalam lemari pendingin.
"Proses dan laju pelepasan energi dari air bervariasi intrinsik dengan keadaan energi awal dari sumber," ujar Dr Changqing seperti dilansir laman Telegraph.
Pekan lalu, Dr Changqing dan Dr Zhang menerbitkan sebuah makalah di jurnal Scientific Reports yang menunjukkan bagaimana molekul air mengatur diri mereka sendiri ketika membentuk es. Keduanya juga menerbitkan sebuah makalah tentang arXiv Chemical Physicsyang menjelaskan efek Mpemba .
Mereka mengatakan bahwa interaksi antara ikatan hidrogen dan ikatan kuat yang memegang atom hidrogen serta oksigen dalam masing-masing molekul bersama -- dikenal sebagai ikatan kovalen-- adalah yang menyebabkan efek Mpemba.
Biasanya ketika cairan dipanaskan, ikatan kovalen antara atom meregang dan menyimpan energi. Namun kedua ilmuwan ini berpandapat bahwa pada air, ikatan hidrogen menghasilkan efek tak biasa yang menyebabkan ikatan kovalen memendek dan menyimpan energi saat dipanaskan.
Hal ini, ujar mereka, mengarah kepada bahwa ikatan melepaskan energi dengan cara yang eksponensial dibanding jumlah awal yang tersimpan ketika didinginkan dalam lemari pendingin. Dengan demikian, air panas akan kehilangan energi lebih cepat ketimbang air dingin.
"Saat didinginkan di lemari pendingin, ikatan H-O melepaskan energi pada tingkat yang eksponensial tergantung pada energi awal yang disimpan dan karena itu efek Mpemba terjadi," kata Dr Changqing.





.jpg)