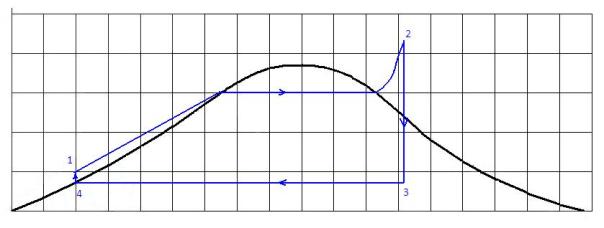
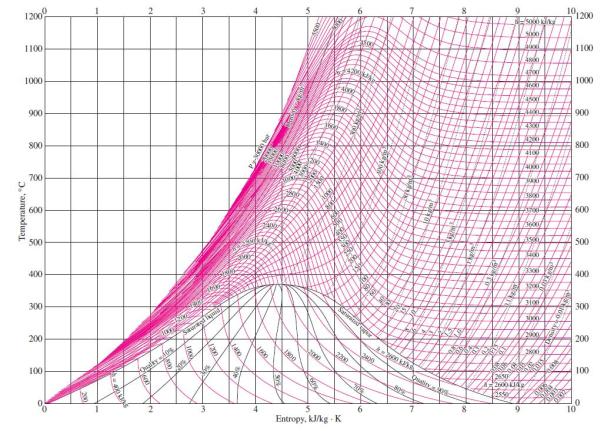
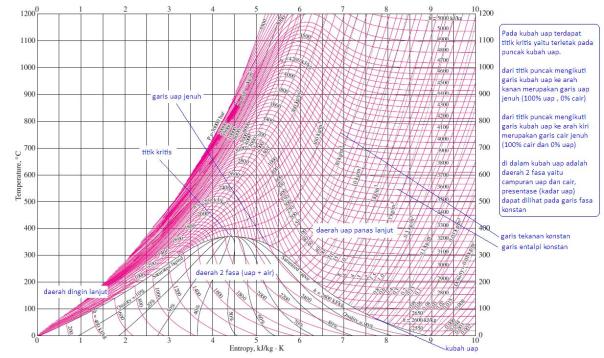
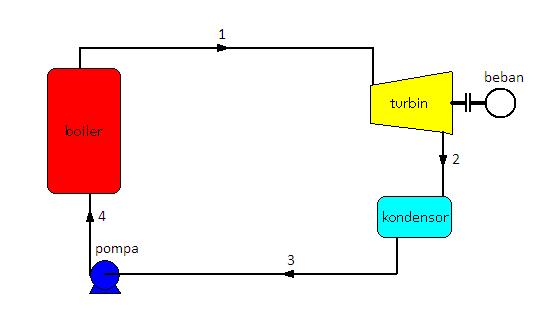
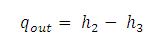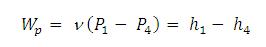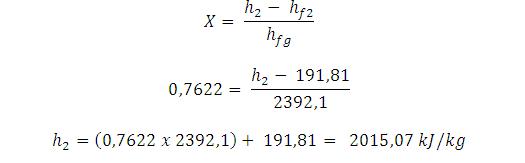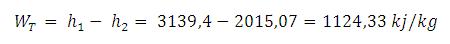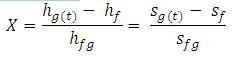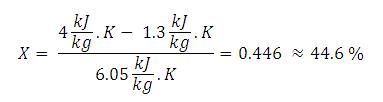Skema pada gambar 5 dapat digambarkan garis kerjanya pada diagram T-s seperti pada gambar 6 berikut ini.
Keterangan gambar 6 :
Proses 1 – 2 adalah proses pada tekanan konstan yang berlangsung pada boiler. Pada proses ini kalor masuk ke dalam sistem (Qin).
Proses 2 – 3 adalah proses ekspansi isentropis (adiabatis reversibel) yang berlangsung di dalam turbin uap. Pada proses ini terjadi kerja keluar sistem (Wout)
Proses 3 – 4 adalah proses pada tekanan konstan yang berlangsung di dalam kondensor. Pada proses ini kalor keluar dari sistem (pembuang kalor) (Qout).
Proses 4 – 1 adalah proses penekanan secara isentropis oleh pompa. Pada proses ini kerja masuk ke dalam sistem (Win).
Pada siklus Rankine ideal sederhana. Air dipompa oleh pompa pengisi boiler ke dalam boiler. Pompa yang bertugas untuk memompakan air ke dalam boiler disebut feed water pump. Pompa ini harus dapat menekan air ke boiler dengan tekanan yang cukup tinggi (sesuai dengan tekanan kerja siklus). Secara ideal pompa bekerja menurut proses isentropis (adiabatis reversibel) dan secara aktual pompa bekerja menurut proses adiabatis irreversibel.
Di dalam boiler, air yang bertekanan tinggi dipanaskan hingga menjadi uap panas lanjut, prosesnya adalah sebagai berikut:
1. Proses ekspansi awal di dalam turbin tekanan tinggi (roda Curtis)
Uap panas lanjut yang bertekanan tinggi diekspansikan di nosel dan kemudian digunakan untuk memutar roda Curtis. Roda Curtis adalah turbin uap jenis turbin implus. Pada roda Curtis terjadi penurunan tekanan yang signifikan.
2. Proses ekspansi pada turbin tingkat menengah.
Turbin tingkat menengah menggunakan turbin jenis reaksi dan tersusun atas beberapa tingkat turbin.
3. Proses ekspansi tingkat akhir.
Pada tingkat akhir ini uap terus diekspansikan hingga tekanan sangat rendah (biasanya dibawah tekanan atmosfir ) dengan bantuan kondensor.
Putaran poros yang dihasilkan dari proses ekspansi uap panas lanjut di dalam turbin digunakan untuk memutar beban. Beban dapat berupa generator listrik seperti di PLTU atau propeler (baling-baling) untuk menggerak kapal.
Uap tekanan rendah dari turbin uap mengalir ke kondensor. Di dalam kondensor, uap didinginkan dengan media pendingin air hingga berubah fase menjadi air. Kemudian air ditampung di dalam tangki dan dipisahkan dari gas-gas yang tersisa dan siap untuk dipompa ke dalam boiler oleh pompa pengisi boiler. Proses ini terus berlanjut dan berulang membentuk sebuah siklus yang disebut siklus Rankine.
Pada siklus Rankine ideal. Ke 4 alat dianggap bekerja pada kondisi Steady flow. Sehingga persamaan energi untuk kondisi steady flow dapat ditulis :
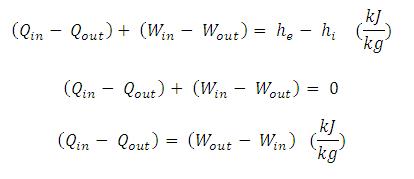
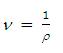
Kalor masuk ke boiler :
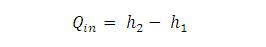
Kerja yang dihasilkan turbin uap :
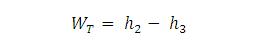
Kalor yang dibuang oleh kondensor :
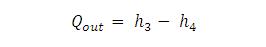
Efisiensi thermal siklus Rankine ideal sederhana dapat dihitung :
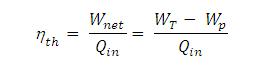 Dimana :
Dimana : 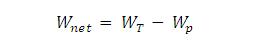 Untuk
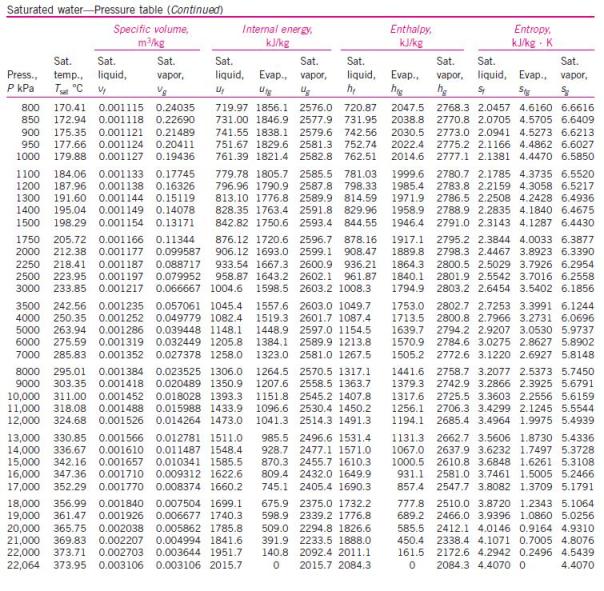
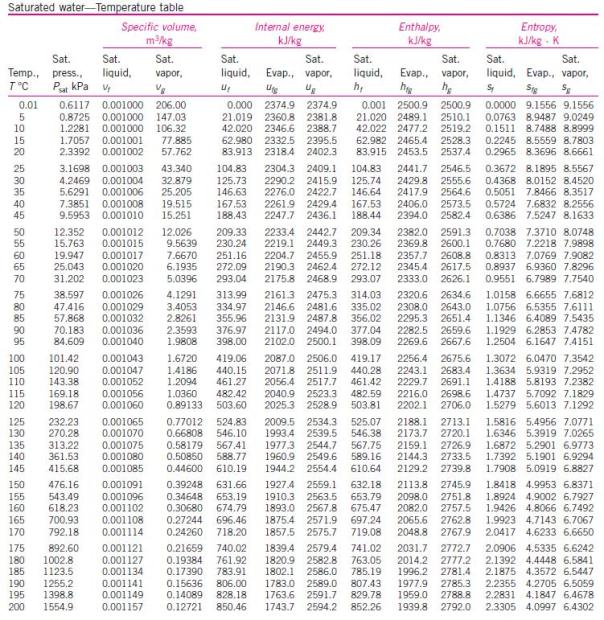
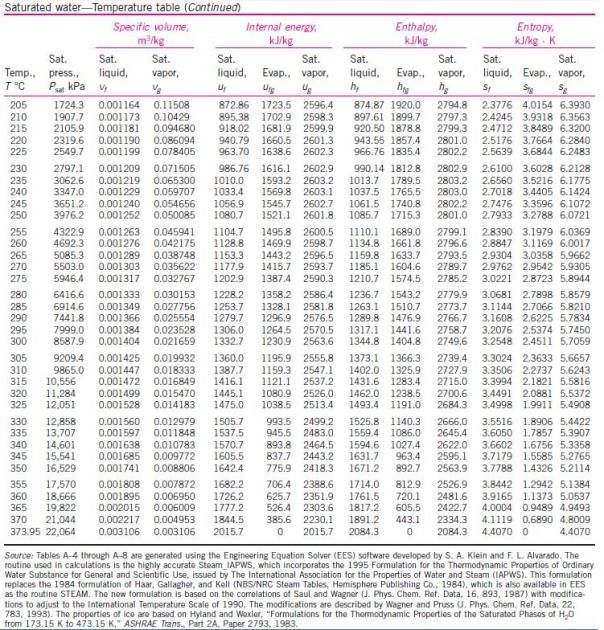
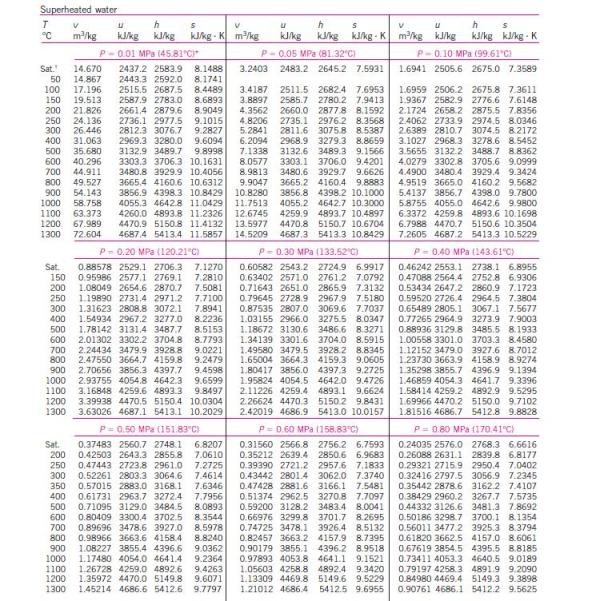
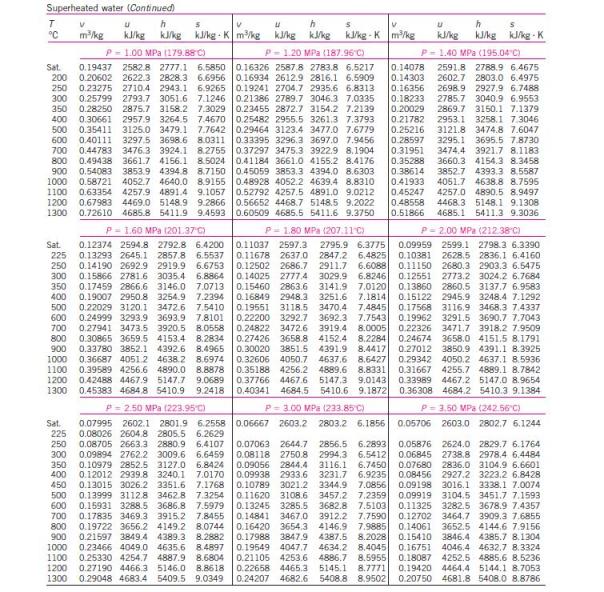
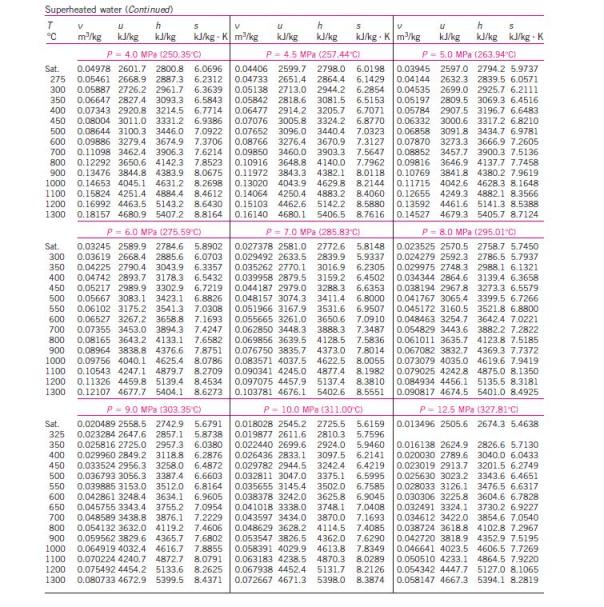
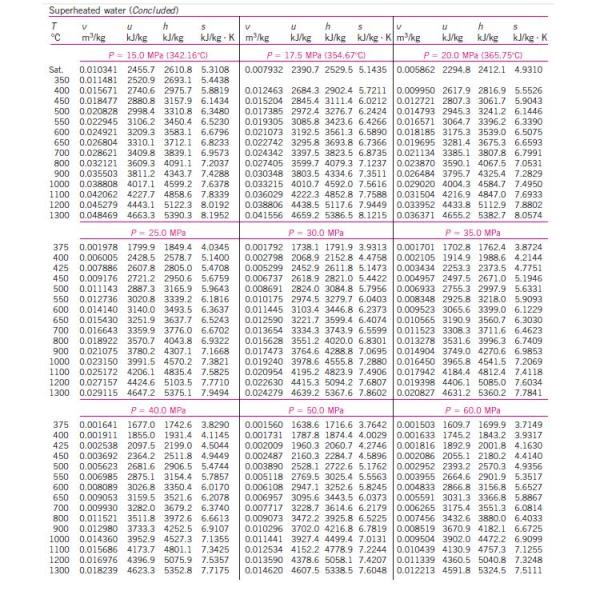
menghitung kinerja siklus Rankine, diperlukan tabel sifat-sifat air dan
uap air. Berikut ini tabel sifat-sifat air dan uap air.
Untuk
menghitung kinerja siklus Rankine, diperlukan tabel sifat-sifat air dan
uap air. Berikut ini tabel sifat-sifat air dan uap air.
Untuk uap jenuh variabel tetap temperatur air :
Untuk uap jenuh dengan variabel tetap tekanan
 data lengkap tentang sifat-sifat termodinamika untuk beberapa fluida dapat didownload pada link berikut ini : http://www.4shared.com/web/preview/doc/FKLvf9Fqba. atau http://www.2shared.com/document/oNTrxxp1/appdxs1_2.html
data lengkap tentang sifat-sifat termodinamika untuk beberapa fluida dapat didownload pada link berikut ini : http://www.4shared.com/web/preview/doc/FKLvf9Fqba. atau http://www.2shared.com/document/oNTrxxp1/appdxs1_2.html
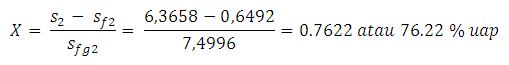 Artinya
kadar uap yang keluar dari turbin menuju kondensor adalah 76,22 % atau
fluida yang keluar dari turbin 76,22 % uap dan 23.78 % cair. Bagian yang
cair ini tidak perlu lagi diembunkan, tetapi 76,22 % uap ini yang harus
dibuang kalornya supaya fasenya berubah menjadi cair. Maka energi total
yang terkandung di dalam 76,22% uap dapat dihitung :
Artinya
kadar uap yang keluar dari turbin menuju kondensor adalah 76,22 % atau
fluida yang keluar dari turbin 76,22 % uap dan 23.78 % cair. Bagian yang
cair ini tidak perlu lagi diembunkan, tetapi 76,22 % uap ini yang harus
dibuang kalornya supaya fasenya berubah menjadi cair. Maka energi total
yang terkandung di dalam 76,22% uap dapat dihitung :
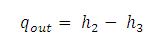
Keterangan gambar 6 :
Proses 1 – 2 adalah proses pada tekanan konstan yang berlangsung pada boiler. Pada proses ini kalor masuk ke dalam sistem (Qin).
Proses 2 – 3 adalah proses ekspansi isentropis (adiabatis reversibel) yang berlangsung di dalam turbin uap. Pada proses ini terjadi kerja keluar sistem (Wout)
Proses 3 – 4 adalah proses pada tekanan konstan yang berlangsung di dalam kondensor. Pada proses ini kalor keluar dari sistem (pembuang kalor) (Qout).
Proses 4 – 1 adalah proses penekanan secara isentropis oleh pompa. Pada proses ini kerja masuk ke dalam sistem (Win).
Pada siklus Rankine ideal sederhana. Air dipompa oleh pompa pengisi boiler ke dalam boiler. Pompa yang bertugas untuk memompakan air ke dalam boiler disebut feed water pump. Pompa ini harus dapat menekan air ke boiler dengan tekanan yang cukup tinggi (sesuai dengan tekanan kerja siklus). Secara ideal pompa bekerja menurut proses isentropis (adiabatis reversibel) dan secara aktual pompa bekerja menurut proses adiabatis irreversibel.
Di dalam boiler, air yang bertekanan tinggi dipanaskan hingga menjadi uap panas lanjut, prosesnya adalah sebagai berikut:
- Ekonomiser, air pertama-tama masuk ke ekonomiser. Ekonomier berfungsi sebagai pemanas awal. Sesuai namanya alat ini berfungsi untuk meningkatkan efisiensi boiler dengan cara menggunakan panas sisa gas buang untuk memanaskan awal air yang masuk ke boiler.
- Evaporator, dari ekonomiser, air masuk ke drum penampung air di evaporator. Di dalam evaporator air dipanaskan melalui pipa-pipa evaporasi hingga berubah menjadi uap. Uap air yang keluar dari evaporator adalah uap jenuh.
- Superheater, selanjutnya uap jenuh dari evaporator masuk ke superheater. Superheater adalah alat penukar kalor yang dirancang khusus untuk memanaskan uap jenuh menjadi uap panas lanjut dengan menggunakan gas panas hasil pembakaran. Uap panas lanjut yang keluar dari superheater siap digunakan untuk memutar turbin uap.
1. Proses ekspansi awal di dalam turbin tekanan tinggi (roda Curtis)
Uap panas lanjut yang bertekanan tinggi diekspansikan di nosel dan kemudian digunakan untuk memutar roda Curtis. Roda Curtis adalah turbin uap jenis turbin implus. Pada roda Curtis terjadi penurunan tekanan yang signifikan.
2. Proses ekspansi pada turbin tingkat menengah.
Turbin tingkat menengah menggunakan turbin jenis reaksi dan tersusun atas beberapa tingkat turbin.
3. Proses ekspansi tingkat akhir.
Pada tingkat akhir ini uap terus diekspansikan hingga tekanan sangat rendah (biasanya dibawah tekanan atmosfir ) dengan bantuan kondensor.
Putaran poros yang dihasilkan dari proses ekspansi uap panas lanjut di dalam turbin digunakan untuk memutar beban. Beban dapat berupa generator listrik seperti di PLTU atau propeler (baling-baling) untuk menggerak kapal.
Uap tekanan rendah dari turbin uap mengalir ke kondensor. Di dalam kondensor, uap didinginkan dengan media pendingin air hingga berubah fase menjadi air. Kemudian air ditampung di dalam tangki dan dipisahkan dari gas-gas yang tersisa dan siap untuk dipompa ke dalam boiler oleh pompa pengisi boiler. Proses ini terus berlanjut dan berulang membentuk sebuah siklus yang disebut siklus Rankine.
Pada siklus Rankine ideal. Ke 4 alat dianggap bekerja pada kondisi Steady flow. Sehingga persamaan energi untuk kondisi steady flow dapat ditulis :
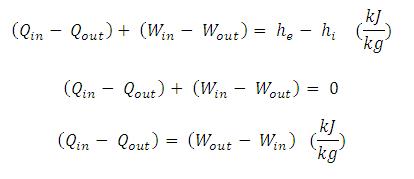
Beberapa proses yang berlangsung pada masing-masing alat adalah :
Kerja pompa :
Dimana ν adalah volume spesifik yang besarnya 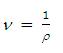
Kalor masuk ke boiler :
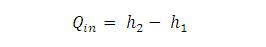
Kerja yang dihasilkan turbin uap :
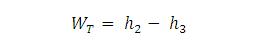
Kalor yang dibuang oleh kondensor :
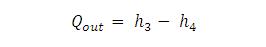
Efisiensi thermal siklus Rankine ideal sederhana dapat dihitung :
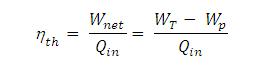 Dimana :
Dimana : 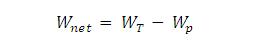 Untuk
menghitung kinerja siklus Rankine, diperlukan tabel sifat-sifat air dan
uap air. Berikut ini tabel sifat-sifat air dan uap air.
Untuk
menghitung kinerja siklus Rankine, diperlukan tabel sifat-sifat air dan
uap air. Berikut ini tabel sifat-sifat air dan uap air.Untuk uap jenuh variabel tetap temperatur air :


Untuk uap jenuh dengan variabel tetap tekanan



 data lengkap tentang sifat-sifat termodinamika untuk beberapa fluida dapat didownload pada link berikut ini : http://www.4shared.com/web/preview/doc/FKLvf9Fqba. atau http://www.2shared.com/document/oNTrxxp1/appdxs1_2.html
data lengkap tentang sifat-sifat termodinamika untuk beberapa fluida dapat didownload pada link berikut ini : http://www.4shared.com/web/preview/doc/FKLvf9Fqba. atau http://www.2shared.com/document/oNTrxxp1/appdxs1_2.html
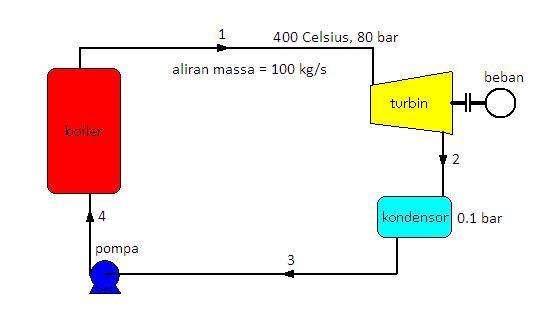
Contoh soal
Sebuah siklus Rankine sederhana ideal bekerja pada temperatur 400 oC
dan tekanan 80 bar. Tekanan kondensor 0,1 bar. Aliran massa uap yang
masuk ke turbin 100 kg/s. Hitunglah kerja turbin, kerja pompa, kalor
masuk, kalor keluar dan efisiensi siklus. daya yang dihasilkan turbin
dan daya netto siklus.
Jawab
Pertama-tama gambarkan skema siklus Rankine sederhana dan lengkapi dengan data-data yang ada di dalam soal
Ditanya : kerja turbin (Wt); Kerja pompa (Wp), kalor masuk (Qin), kalor keluar (Qout), efisiensi termodinamika (ηth), daya turbin (Pt) dan daya netto siklus (Pnett).
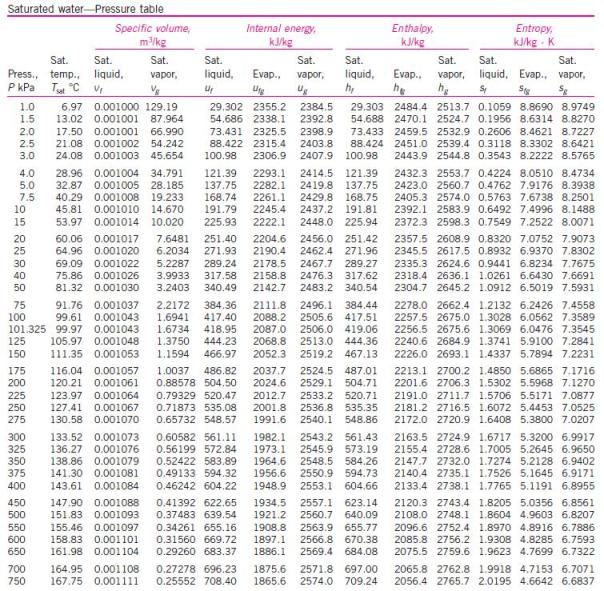
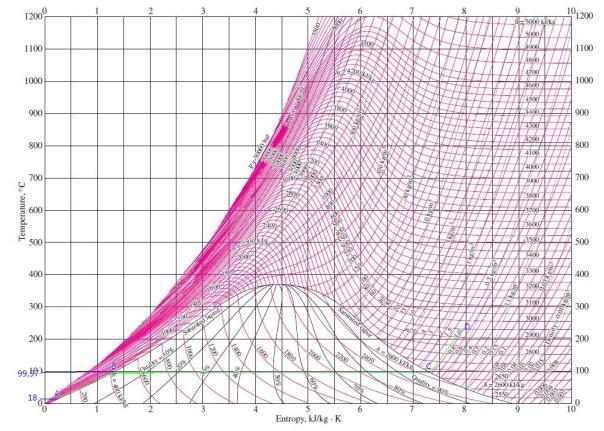
Dari tabel sifat-sifat uap panas lanjut di dapat :
Entalpi uap masuk ke turbin : h1 = 3139,4 kJ/kg
Entropi uap masuk ke turbin : s1 = 6,3658 kJ/kg.K
Entropi uap keluar turbin sama dengan entropi uap masul turbin (proses ideal atau isentropis) sehingga s1 = s2 = 6,3658 kJ/kg.K
Dari tabel uap jenuh, pada tekanan 0,1 bar (10 kPa) didapat :
Entalpi fase uap (hg2) = 2583,9 kJ/kg
Entalpi fase cair (hf2) = 191,81 kJ/kg
Entalpi perubahan fase (hfg2) = 2392,1 kj/kg
Entropi fase uap (sg1) = 8,1488 kJ/kg.K
Entropi fase cair (sf2) = 0,6492 kJ/kg.K
Entropi perubahan fase (sfg2) = 7,4996 kJ/kg.K
Fraksi (kadar) uap (X) dapat dihitung :
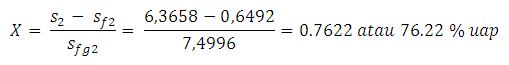 Artinya
kadar uap yang keluar dari turbin menuju kondensor adalah 76,22 % atau
fluida yang keluar dari turbin 76,22 % uap dan 23.78 % cair. Bagian yang
cair ini tidak perlu lagi diembunkan, tetapi 76,22 % uap ini yang harus
dibuang kalornya supaya fasenya berubah menjadi cair. Maka energi total
yang terkandung di dalam 76,22% uap dapat dihitung :
Artinya
kadar uap yang keluar dari turbin menuju kondensor adalah 76,22 % atau
fluida yang keluar dari turbin 76,22 % uap dan 23.78 % cair. Bagian yang
cair ini tidak perlu lagi diembunkan, tetapi 76,22 % uap ini yang harus
dibuang kalornya supaya fasenya berubah menjadi cair. Maka energi total
yang terkandung di dalam 76,22% uap dapat dihitung :